Neurofunctional changes after a single mirror therapy intervention in chronic ischemic stroke
Novaes M. ; Palhano-Fontes F. ; Peres A. ; Mazzetto-Betti K. ; Pelicioni M. ; Andrade K. ; Santos A. ; Pontes-Neto O. ; Araujo D.
Introduction
La thérapie miroir est une technique de soin alternative de plus en plus utilisée, notamment dans le cadre de la rééducation post-AVC. Bien que des études récentes suggèrent les effets positifs de ce type de soin chez des patients AVC chroniques, peu de choses sont clairement identifiées sur les mécanismes mis en jeu au niveau cortical. L’objectif est donc d’identifier les modifications fonctionnelles corticales induites par une simple séance de thérapie miroir chez des patients AVC ischémiques à l’aide de l’Imagerie par Résonnance Magnétique fonctionnelle (IRMf) et la Stimulation Magnétique Transcrânienne (TMS).
L’excitabilité du cortex moteur (M1) est un marqueur important de la récupération fonctionnelle chez des patients post AVC. Dans l’état actuel des connaissances, on pense que le dérèglement de la balance inter-hémisphérique (consécutive à l’AVC) peut entraîner une forme d’inhibition de l’hémisphère lésé et compromettre la récupération motrice des patients.
Une voie de la rééducation pourrait donc consister en la stimulation de l’hémisphère lésé en parallèle d’une diminution de l’activité de l’hémisphère controlatéral. La thérapie miroir pourrait être un outil permettant ce type d’approche.
Matériels & Méthodes
Participants
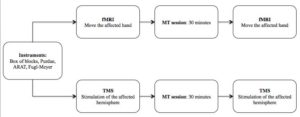
10 patients ayant subis un AVC ischémiques depuis plus de 6 mois ont été inclus dans l’étude. Deux groupes de 5 patients ont été constitués afin d’évaluer l’impact de la thérapie miroir sur des éventuelles adaptations neurofonctionnelles. Des critères d’efficacité secondaires ont été programmés afin d’évaluer le niveau de récupération fonctionnelle (Box & Block Test, Purdue Pegboard Test, l’ARAT, Fugl-Meyer).
Outils cliniques
L’IRMf permet de visualiser l’activité cérébrale et les structures mises en jeu dans différentes conditions. La TMS quant à elle permet de mesurer la qualité des voies cortico-spinales et la conduction d’un ordre moteur jusqu’aux effecteurs musculaires par le biais de Potentiels Évoqués Moteurs PEM. Ces deux techniques seront utilisées pour mesurer les effets d’une session unique de thérapie miroir de 30 minutes.
Thérapie miroir
Les auteurs ont choisi des mouvements analytiques simples à reproduire avec la main parétique en thérapie miroir :
- Abduction adduction poignet
- Flexion extension poignet
- Prono-supination
- Opposition du pouce
Les consignes en thérapie miroir étaient de ne pas mobiliser le bras parétique situé derrière le miroir. Les séances de thérapie miroir étaient supervisées par un évaluateur qui vérifiait le déroulement de la session et la présence de syncinésies. Le séances étaient de 30 minutes.
Résultats
Les auteurs notent une augmentation significative post séance de l’amplitude des PEM sur le membre affecté. La comparaison des cartographies IRMf pré et post-session montre un changement au niveau de la balance de l’activité de M1 en direction de l’hémisphère lésé. Cette tendance à une relocalisation de l’activité cérébrale sur l’hémisphère lésé se limite à la zone dédiée à la main parétique.
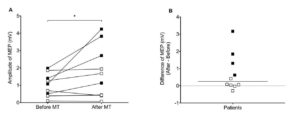
Amplitude des Potentiels Évoqués Moteurs A-Valeur médiane des PEM avant et aprés une session unique de thérapie miroir (*p<0.05) B-Evolutions individuelles des PEM. La ligne horizontale représente la valeur moyenne. La valeur des PEM avant et aprés ulune session unique de thérapie miroir augmente de façon significative (marqueurs noirs; *p<0.05)
Conclusions
Cette étude suggère qu’une session unique de 30 minutes de thérapie miroir induit une augmentation de l’amplitude des PEM sur le membre affecté. L’IRMf montre un déplacement de l’activité cérébrale de l’hémisphère sain à l’aire motrice de l’hémisphère lésé. Ce phénomène s’accompagne d’une modification de la balance inter-hémisphérique avec une baisse de l’activité de l’hémisphère sain et une augmentation de l’hémisphère opposé.
Néanmoins, il est nécessaire de mener des études complémentaires pouvoir valider ces résultats avec des échantillons plus conséquents car les variations inter-individuelles sur les mesures TMS et IRMf peuvent être importantes. De même, l’absence de groupe contrôle est un facteur limitant. Enfin, il est important de noter que les auteurs n’ont pas noté d’amélioration fonctionnelle sur les tests.
-
Cao Y, D’Olhaberriague L, Vikingstad EM, Levine SR, Welch KM. Pilot study of functional MRI to assess cerebral activation of motor function after poststroke hemiparesis. Stroke. 1998;29(1):112-122. https://www.ncbi.nlm.nih.gov/pubmed/9445338
-
Cramer SC, Nelles G, Benson RR, Kaplan JD, Parker RA, Kwong KK, Kennedy DN, Finklestein SP, Rosen BR. A functional MRI study of subjects recovered from hemiparetic stroke. Stroke. 1997;28(12):2518-2527. https://www.ncbi.nlm.nih.gov/pubmed/9412643
-
Pineiro R, Pendlebury S, Johansen-Berg H, Matthews PM. Functional MRI detects posterior shifts in primary sensorimotor cortex activation after stroke: evidence of local adaptive reorganization? Stroke. 2001;32(5):1134-1139. https://www.ncbi.nlm.nih.gov/pubmed/11340222
-
Michielsen ME, Selles RW, van der Geest JN, Eckhardt M, Yavuzer G, Stam HJ, Smits M, Ribbers GM, Bussmann JBJ. Motor Recovery and Cortical Reorganization After Mirror Therapy in Chronic Stroke Patients: A Phase II Randomized Controlled Trial. Neurorehabil Neural Repair. 2011;25(3):223-233. https://www.ncbi.nlm.nih.gov/pubmed/21051765
-
Cunningham D a, Machado A, Janini D, Varnerin N, Bonnett C, Yue G, Jones S, Lowe M, Beall E, Sakaie K, Plow EB. Assessment of inter-hemispheric imbalance using imaging and noninvasive brain stimulation in patients with chronic stroke. Arch Phys Med Rehabil. 2015;96(4):S94-S103. https://www.ncbi.nlm.nih.gov/pubmed/25194451

J’aimerais savoir ou me procurer le programme pour la thérapie du miroir afin que je puisse faire les exercices.
Merci
Bonjour
Mon mari vient d’être amputé de son bras gauche suite à un cancer des os. Osteosarcome.
Les douleurs dans son bras fantôme sont intenses.
Pouvez-vous nous aider en proposant des exercices. Merci
Après une amputation du quadriceps de la cuisse. J’ai besoin de rééduquer ma jambe.
Ou puis je avoir des coordonnées de praticiens faisant usage de cette méthode ???? J’ai subie un AVC et je suis diminue
Merci me berdah