La prise en charge post-AVC
Généralités
L’interruption de la circulation sanguine sur un territoire cérébral endommage ou détruit les tissus environnants. Les conséquences qui en découlent sont donc fonction de l’aire cérébrale touchée et de ses attributions. C’est pourquoi les symptômes du patient AVC sont variés et ne peuvent être limités à une description caractéristique d’un patient à un autre.
Wilder Penfield est un neurochirurgien Canadien qui a travaillé de longues années sur l’Epilepsie au milieu du vingtième siècle. Une des méthodes alors employée était de détruire des neurones du cerveau dans les zones où siégeaient les accès de crise épileptique. Par ailleurs, il applique à même la surface du cerveau une microélectrode délivrant de légères stimulations électriques qui induisent des contractions musculaires sur diverses parties du corps. Dès lors, il entreprend de repérer l’ensemble des représentations motrices au niveau du cerveau ainsi que la cartographie sensitive. Wilder Penfield et Theodore Brown Rasmussen publient en 1950 « The Cerebral Cortex of Man » qui révèle pour la première fois l’Homonculus dit « de Penfield » (Figure 1). On peut alors se rendre compte de l’attribution spatiale des zones cérébrales et de leur rôle, ainsi que de l’importance relative de ces représentations. Suivant la localisation de l’AVC, nous pouvons donc déduire les zones motrices et sensitives qui ont été lésées et par là-même les fonctions altérées.
Dans le cadre de patients AVC, la Haute Autorité de Santé (HAS) recommande une prise en charge pluridisciplinaire. Elle doit permettre une optimisation du suivi du patient entre les différentes structures d’accueil, des soins apportés et de la pérennisation des progrès issus de la rééducation (Haute Autorité de Santé, 2012). Nous centrerons ici notre attention sur les récupérations motrices classiques et ne traiterons pas des fonctions de déglutition ou de langage qui doivent aussi être prises en compte par des professionnels spécialistes.
Même si l’on note régulièrement une récupération spontanée après l’AVC, il est désormais largement admis que la rééducation doit être initiée le plus tôt possible. Les programmes de rééducation offrent de très bons résultats sur les premiers mois. On constate ensuite, aux alentours du sixième mois, l’atteinte d’un plateau de récupération à partir duquel les progrès espérés seront moindres. Différentes méthodes et outils sont aujourd’hui utilisables par les thérapeutes afin d’optimiser les soins. Nous nous proposons de passer en revue, de façon non exhaustive, l’arsenal thérapeutique à la disposition des rééducateurs dans la prise en charge des patients AVC.
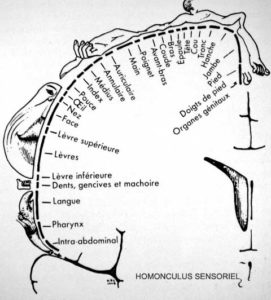
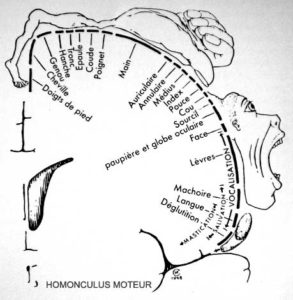
Figure 1 – Homonculus de Penfield.
Homonculus sensoriel et homonculus moteur.
Sur le schéma est présenté une coupe frontale du cerveau en arrière du sillon central ou de Rolando (du sommet du crâne jusqu’au niveau de l’oreille). Les différentes parties du corps sont représentées en fonction de la richesse des terminaisons nerveuses qui leurs sont affectées. Penfield et TB. Rasmussen – The Cerebral Cortex of Man (1950)
Plasticité cérébrale
Au cours des trois premiers mois, on observe des récupérations motrices et cognitives spontanées. Elles sont plus discrètes dans l’année qui suit. Cependant, le principe selon lequel une lésion cérébrale avait un caractère définitif chez l’Homme n’a été abandonné que récemment. Il apparaît alors évident qu’il existe une réorganisation corticale compensatrice adaptée en réponse aux pertes fonctionnelles dues à une blessure ou une pathologie (Chen et al., 2002).
La plasticité cérébrale est le principe physiologique qui supporte les mécanismes d’apprentissage. Les expériences vécues, ainsi que la maturation progressive du cerveau, permettent un renforcement progressif de certaines connections synaptiques au détriment d’autres voies qui disparaissent progressivement. L’apprentissage est donc un processus dynamique et itératif permettant de modifier les paramètres d’un réseau en réaction avec les stimuli qu’il reçoit de son environnement.
C’est ce même principe de modulation des connections synaptiques qui offre au patient AVC, la capacité de développer une nouvelle cartographie cérébrale en réponse à une perception modifiée de son environnement. En effet, dès lors que le patient ne peut plus évoluer de la même façon dans son environnement, il est obligé de développer de nouvelles stratégies, des compensations qui seront, avec la répétition, source de nouveaux apprentissages.
Ainsi, Chollet et al. (1991) ont montré qu’une action de la main déficitaire stimule des aires sensorimotrices primaires dans les hémisphères droit et gauche, tandis que la main saine stimule seulement les aires controlatérales. Plusieurs équipes (Fridman et al., 2004; Frost et al., 2003), ont, quant à elles, montrés que les zones cérébrales adjacentes aux zones lésionnelles pouvaient les suppléer dans l’élaboration des tâches qui leur étaient dévolues. Ainsi, chez des patients AVC qui témoignaient d’une bonne récupération, elles ont noté une forte participation du cortex prémoteur dorsal dans le contrôle des paramètres de mouvement en lieu et place de l’aire motrice primaire (M1), siège de l’AVC.
Par ailleurs, il est possible de relever des réponses inadaptées ou « mal-adaptatives » qui gênent la récupération du patient. La revue de littérature de Takeuchi and Izumi (2012) fait le point sur les attitudes compensatrices néfastes (contre-productive à la rééducation) qui peuvent apparaître chez les patients comme la non utilisation acquise du membre pathologique, la réduction des amplitudes articulaires et les douleurs d’ordre neurologique. C’est pourquoi, il est particulièrement important de bien comprendre le phénomène de plasticité afin d’optimiser la rééducation des patients et de leur offrir une qualité de vie meilleure.
Pour conclure, la réorganisation qui s’opère dans les tissus intactes peut fournir un support neuronal pour encourager les adaptations et soutenir les récupérations motrices post-AVC. Kwakkel et al. en 2004 résument les processus concourant à la récupération cérébrale après AVC par les trois principes suivants:
- Restauration: réparation des dommages subis au niveau de la zone cérébrale lésée.
- Substitution: réorganisation des voies neuronales épargnées pour réapprendre les fonctions perdues.
- Compensation: réduction de la différence entre les compétences du patient et les exigences de son environnement.
Bibliographie
Chen, R., Cohen, L.G., Hallett, M., 2002. Nervous system reorganization following injury. Neuroscience 111, 761–773.
Chollet, F., DiPiero, V., Wise, R.J., Brooks, D.J., Dolan, R.J., Frackowiak, R.S., 1991. The functional anatomy of motor recovery after stroke in humans: a study with positron emission tomography. Ann. Neurol. 29, 63–71.
Fridman, E.A., Hanakawa, T., Chung, M., Hummel, F., Leiguarda, R.C., Cohen, L.G., 2004. Reorganization of the human ipsilesional premotor cortex after stroke. Brain J. Neurol. 127, 747–758.
Frost, S., Barbay, S., Friel, K., Plautz, E., Nudo, R., 2003. Reorganization of Remote Cortical Regions After Ischemic Brain Injury: A Potential Substrate for Stroke Recovery. J. Neurophysiol. 89, 3205–3214.
Haute Autorité de Santé, 2012. Accident Vasculaire Cérébral: méthodes de rééducation de la fonction motrice chez l’adulte. “Recommandations pour la pratique clinique.”
Kwakkel, G., Kollen, B., Lindeman, E., 2004. Understanding the pattern of functional recovery after stroke: facts and theories. Restor. Neurol. Neurosci. 22, 281–299.
Takeuchi, N., Izumi, S.-I., 2012. Maladaptive Plasticity for Motor Recovery after Stroke: Mechanisms and Approaches. Neural Plast. 2012, 1–9.
